Е. Дагар, кандидат медицинских наук, врач-косметолог, главный врач клиники «Дом красоты Ювента» (Саранск) и клиники «Аэстетика», Москва, Россия
1 Введение
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов прошлого столетия.
Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году группа исследователей во главе с Р. Hench была удостоена Нобелевской премии за «...открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов» [1].
2 ЛЕЧЕНИЕ РУБЦОВ С ИСПОЛЬЗОВАНИЕМ ГКС
2.1. Обзор ГКС-препаратов
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией (кортизон и гидрокортизон (кортизол)), так и их синтезированные аналоги – преднизон, преднизолон, метилпреднизолон и другие, включая галогенированные (фторированные) производные – триамцинолон, дексаметазон, бетаметазон и др. [1].
В зависимости от длительности действия ГКС делятся:
– на короткодействующие – 8–12 час. (кортизон, гидрокортизон);
– длительного действия – 12–36 час. (преднизолон, метилпреднизолон, триамцинолон);
– сверхдлительного действия – 36–72 час. (дексаметазон, бетаметазон) [2].
Механизм действия глюкокортикостероидных гормонов широк. Основные эффекты, применяемые в лечении гипертрофических (ГР) и келоидных рубцов (КР), – это противовоспалительное и антипролиферативное действие.
С чем связан такой широкий спектр противовоспалительной активности ГКС? Мишени их действия, рецепторы глюкокортикоидов, расположены во всех типах клеток (за исключением стволовых). Связываясь с внутриклеточными рецепторами, ГКС повышают экспрессию генов, ответственных за консолидацию антивоспалительного ответа (трансактивация). Активность генов, участвующих в продукции провоспалительных белков, напротив, находится под негативным контролем ГКС, т.е. в их присутствии угнетается (трансрепрессия). Учитывая, что ГКС регулируют активность на геномном уровне, их действие развивается не сразу, в среднем спустя 2 часа после применения, но имеет продолжительный характер (от 8 до 36 час. – в зависимости от препарата). Таким образом, к особенностям ГКС относится уникальный двойной механизм подавления воспаления.
Механизм трансрепрессии (trans-repression)
Гормон-рецепторные комплексы (в виде мономера) непосредственно и через молекулы СВР (белок, связывающий цАМФ-чувствительный элемент), взаимодействуют с факторами транскрипции (NF-kB, AP-1 и др.), которые активируются под влиянием медиаторов воспаления, оксидантов и вирусов. Итогом этого является торможение транскрипции воспалительных генов (транс-репрессия). Наблюдается снижение образования белков и пептидов: индуцибильные формы ЦОГ-2, NOS, ФЛ А2, провоспалительные цитокины (IL 1–6, ФНО-альфа, ГМКСФ), хемокины (IL-8, эотаксин, Rantes, моноцитарный хемотаксический белок, воспалительный белок макрофагов [2].
В процессе заживления раны кортикостероиды уменьшают рубцеобразование посредством уменьшения синтеза коллагена, глюкозаминогликанов, пролиферации фибробластов. Также они вызывают дегенерацию коллагена и фибробластов [3].
Противопоказания к применению ГКС в практике косметолога:
– лактация;
– текущая или планируемая беременность;
– наличие сахарного диабета или нарушения свертывания крови;
– инфекции в местах запланированных инъекций;
– системное лечение кортикостероидами, 5-фторурацилом;
– известная аллергия на любой из компонентов, находящихся в составе препаратов [4].
2.2. Лечение рубцов с использованием ГКС
Несмотря на относительно небольшое количество проведенных рандомизированных проспективных исследований, существует общее мнение, что инъекции ГКС эффективны и являются терапией первой линии для лечения келоидных рубцов и терапией второй линии для лечения гипертрофических рубцов, если другие, более простые методы лечения неэффективны. Следуя клиническим рекомендациям 2015 года (уровень убедительности рекомендации В, уровень достоверности доказательств 1), рекомендуемые глюкокортикостероидные препараты для локального применения в терапии гипертрофических и келоидных рубцов – это Триамцинолона ацетонид и Бетаметазона дипропионат/Натрия фосфат [4]. Препараты Дексаметазона фосфат и Метилпреднизолон внесены в проект будущих клинических рекомендаций.
Правила проведения ГКС-терапии гипертрофических и келоидных рубцов
Первоначально в рубец вводят относительно небольшую дозу кортикостероида, вызывающую его побледнение. Спустя 4–6 недель рубец осматривают и, если отмечают признаки его регрессии, инъекцию повторяют в той же дозе.
Если изначально эффект не достигнут, то концентрацию и дозу кортикостероида увеличивают в 2–4 раза, разбавив его местным анестетиком в соотношении 1 : 1.
Проводят не более 4–6 сеансов [5].
Техника введения ГКС-препаратов
Для инъекций используют шприц объемом 1–2 мл и иглу калибра 27–30G. Иглу вводят вглубь рубца максимально параллельно поверхности кожи. Инъекции выполняют с различных точек. Для предупреждения липолиза подкожно-жировой клетчатки в области рубца острие иглы должно быть направлено вверх. Заполняют весь келоид так, чтобы его поверхность побледнела [6].
2.3. Дозировка препаратов
Подбор дозировки Триамцинолона (ТА)
Триамцинолон выпускается в ампулах объемом 1 мл. Для внутриочаговых инъекций применяют ТА в растворе с 2-процентным лидокаином, водой для инъекций или физиологическим раствором в концентрации от 5 до 40 мг/мл. Стандартная дозировка ТА составляет 10 мг на линейный сантиметр келоида. Максимальная однократная доза для детей до 18 лет составляет 20 мг/мл, для взрослых – 40 мг/ мл.
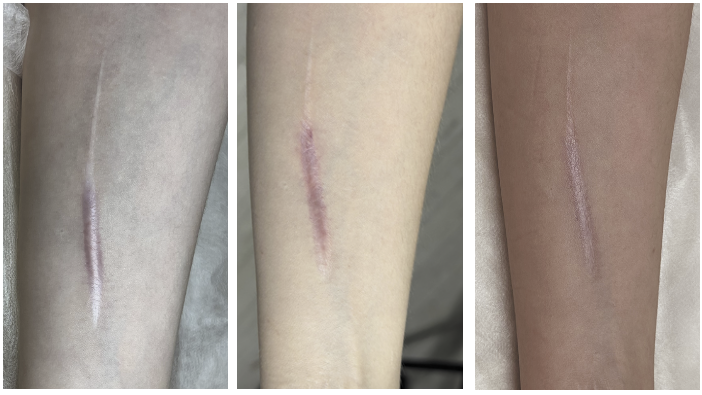
Стандартной программы лечения не существует, т.к. некоторые пациенты отвечают на стероиды очень быстро, тогда как другие требуют более длительного курса инъекций. При этом необходимо помнить, что кристаллы Триамцинолона иногда остаются в тканях дольше 4 недель. Увеличение дозы и повторение инъекций без соблюдения адекватного интервала между ними приводит к накоплению кристаллов Триамцинолона, что может вызвать длительную атрофию вокруг очага (рис. 1). Некоторые пациенты очень чувствительны, поэтому атрофия у них может развиться быстро и даже при низких концентрациях [6].
История применения глюкокортикостероидов (ГКС) в клинической практике насчитывает чуть более полувека, хотя «антиревматическая субстанция Х» была известна еще с 20-х годов прошлого столетия.
Детальное изучение клинической значимости гормонов коры надпочечников, начатое Edward Calvin Kendall и Tadeus Reichstein, было продолжено только после того, как Philip Hench в конце 40-х годов обратил внимание на улучшение течения ревматоидного артрита при желтухе и беременности. В 1950 году группа исследователей во главе с Р. Hench была удостоена Нобелевской премии за «...открытия в отношении гормонов коры надпочечников, их структуры и биологических эффектов» [1].
2 ЛЕЧЕНИЕ РУБЦОВ С ИСПОЛЬЗОВАНИЕМ ГКС
2.1. Обзор ГКС-препаратов
В настоящее время к ГКС относятся как естественные гормоны коры надпочечников с преимущественно глюкокортикоидной функцией (кортизон и гидрокортизон (кортизол)), так и их синтезированные аналоги – преднизон, преднизолон, метилпреднизолон и другие, включая галогенированные (фторированные) производные – триамцинолон, дексаметазон, бетаметазон и др. [1].
В зависимости от длительности действия ГКС делятся:
– на короткодействующие – 8–12 час. (кортизон, гидрокортизон);
– длительного действия – 12–36 час. (преднизолон, метилпреднизолон, триамцинолон);
– сверхдлительного действия – 36–72 час. (дексаметазон, бетаметазон) [2].
Механизм действия глюкокортикостероидных гормонов широк. Основные эффекты, применяемые в лечении гипертрофических (ГР) и келоидных рубцов (КР), – это противовоспалительное и антипролиферативное действие.
С чем связан такой широкий спектр противовоспалительной активности ГКС? Мишени их действия, рецепторы глюкокортикоидов, расположены во всех типах клеток (за исключением стволовых). Связываясь с внутриклеточными рецепторами, ГКС повышают экспрессию генов, ответственных за консолидацию антивоспалительного ответа (трансактивация). Активность генов, участвующих в продукции провоспалительных белков, напротив, находится под негативным контролем ГКС, т.е. в их присутствии угнетается (трансрепрессия). Учитывая, что ГКС регулируют активность на геномном уровне, их действие развивается не сразу, в среднем спустя 2 часа после применения, но имеет продолжительный характер (от 8 до 36 час. – в зависимости от препарата). Таким образом, к особенностям ГКС относится уникальный двойной механизм подавления воспаления.
Механизм трансрепрессии (trans-repression)
Гормон-рецепторные комплексы (в виде мономера) непосредственно и через молекулы СВР (белок, связывающий цАМФ-чувствительный элемент), взаимодействуют с факторами транскрипции (NF-kB, AP-1 и др.), которые активируются под влиянием медиаторов воспаления, оксидантов и вирусов. Итогом этого является торможение транскрипции воспалительных генов (транс-репрессия). Наблюдается снижение образования белков и пептидов: индуцибильные формы ЦОГ-2, NOS, ФЛ А2, провоспалительные цитокины (IL 1–6, ФНО-альфа, ГМКСФ), хемокины (IL-8, эотаксин, Rantes, моноцитарный хемотаксический белок, воспалительный белок макрофагов [2].
В процессе заживления раны кортикостероиды уменьшают рубцеобразование посредством уменьшения синтеза коллагена, глюкозаминогликанов, пролиферации фибробластов. Также они вызывают дегенерацию коллагена и фибробластов [3].
Противопоказания к применению ГКС в практике косметолога:
– лактация;
– текущая или планируемая беременность;
– наличие сахарного диабета или нарушения свертывания крови;
– инфекции в местах запланированных инъекций;
– системное лечение кортикостероидами, 5-фторурацилом;
– известная аллергия на любой из компонентов, находящихся в составе препаратов [4].
2.2. Лечение рубцов с использованием ГКС
Несмотря на относительно небольшое количество проведенных рандомизированных проспективных исследований, существует общее мнение, что инъекции ГКС эффективны и являются терапией первой линии для лечения келоидных рубцов и терапией второй линии для лечения гипертрофических рубцов, если другие, более простые методы лечения неэффективны. Следуя клиническим рекомендациям 2015 года (уровень убедительности рекомендации В, уровень достоверности доказательств 1), рекомендуемые глюкокортикостероидные препараты для локального применения в терапии гипертрофических и келоидных рубцов – это Триамцинолона ацетонид и Бетаметазона дипропионат/Натрия фосфат [4]. Препараты Дексаметазона фосфат и Метилпреднизолон внесены в проект будущих клинических рекомендаций.
Правила проведения ГКС-терапии гипертрофических и келоидных рубцов
Первоначально в рубец вводят относительно небольшую дозу кортикостероида, вызывающую его побледнение. Спустя 4–6 недель рубец осматривают и, если отмечают признаки его регрессии, инъекцию повторяют в той же дозе.
Если изначально эффект не достигнут, то концентрацию и дозу кортикостероида увеличивают в 2–4 раза, разбавив его местным анестетиком в соотношении 1 : 1.
Проводят не более 4–6 сеансов [5].
Техника введения ГКС-препаратов
Для инъекций используют шприц объемом 1–2 мл и иглу калибра 27–30G. Иглу вводят вглубь рубца максимально параллельно поверхности кожи. Инъекции выполняют с различных точек. Для предупреждения липолиза подкожно-жировой клетчатки в области рубца острие иглы должно быть направлено вверх. Заполняют весь келоид так, чтобы его поверхность побледнела [6].
2.3. Дозировка препаратов
Подбор дозировки Триамцинолона (ТА)
Триамцинолон выпускается в ампулах объемом 1 мл. Для внутриочаговых инъекций применяют ТА в растворе с 2-процентным лидокаином, водой для инъекций или физиологическим раствором в концентрации от 5 до 40 мг/мл. Стандартная дозировка ТА составляет 10 мг на линейный сантиметр келоида. Максимальная однократная доза для детей до 18 лет составляет 20 мг/мл, для взрослых – 40 мг/ мл.
Стандартной программы лечения не существует, т.к. некоторые пациенты отвечают на стероиды очень быстро, тогда как другие требуют более длительного курса инъекций. При этом необходимо помнить, что кристаллы Триамцинолона иногда остаются в тканях дольше 4 недель. Увеличение дозы и повторение инъекций без соблюдения адекватного интервала между ними приводит к накоплению кристаллов Триамцинолона, что может вызвать длительную атрофию вокруг очага (рис. 1). Некоторые пациенты очень чувствительны, поэтому атрофия у них может развиться быстро и даже при низких концентрациях [6].

Было проведено три процедуры п/к введения Кеналога, промежуток между процедурами составил четыре недели. К 4-й процедуре над поверхностью кожи обнаружили выступающие плотные образования белого цвета с неровными краями – отложения триамцинолона ацетонида.
Многократные подкожные инъекции в область очага и даже в нормальную кожу рядом с очагом также вызывают атрофию и ухудшают внешний вид келоида. Инъекции внутрь очагов сами по себе не изменяют длину и ширину КР [6].
Подбор дозировки Бетаметазона (Дипрометы, Дипроспана)
Препарат Дипромета/Дипроспан выпускается в шприцах/ампулах объемом 1 мл в дозировке 7 мг/мл. При местном введении одновременное применение местноанестезирующего препарата необходимо лишь в редких случаях, т.к. введение препарата безболезненно. Если оно желательно, то препарат Дипромета/Дипроспан можно смешать с одно- или двухпроцентным раствором прокаина или лидокаина, не содержащим метилпарабена, пропилпарабена, фенола и других подобных веществ. В шприц с препаратом Дипромета набирают из ампулы местный анестетик и встряхивают в течение короткого периода времени, после чего полученный раствор вводят в ткань рубца.
Необходимую дозу суспензии препарата Дипроспан сначала из флакона набирают в шприц, затем в этот же шприц набирают из ампулы требуемое количество местного анестетика и встряхивают в течение короткого периода времени. Препарат Дипромета/Дипроспан следует вводить в/к непосредственно в очаг поражения. Если не вводить препарат непосредственно в пораженную ткань, то в ответ на терапию возможно развитие легкого системного эффекта препарата. Препарат Дипромета/Дипроспан вводится в/к (не п/к) в расчете 0,2 мл/см2 (дозировка рассчитывается для неразведенного препарата). Общее количество препарата, вводимого на всех участках в течение каждой недели, не должно превышать 1 мл. Для введения в очаг поражения рекомендуется применять туберкулиновый шприц с иглой калибра 26–27G [7].
Препараты Метилпреднизолон и Дексаметазон пока не включены в клинические рекомендации по лечению ГР (это только в проекте), но тем не менее в их инструкциях есть показания по лечению келоидных рубцов.
Подбор дозировки метилпреднизолона (Депо-Медрол)
Способ введения и режим дозирования подбираются индивидуально в зависимости от характера и тяжести заболевания, возраста и состояния пациента, ответа на проводимое лечение. Техника введения препарата не отличается от вышеописанных. В виде суспензии (депо-форм) препарат вводится в/к в область кожных повреждений не более 20–60 мг с интервалом в 1–4 недели [7].
Подбор дозировки Дексаметазона фосфата
Режим дозирования является индивидуальным и зависит от показаний, состояния больного и его реакции на терапию. Препарат вводят в/в, медленно, струйно или капельно (при острых и неотложных состояниях); в/м; возможно также локальное (в патологическое образование) введение. В остром периоде при различных заболеваниях и в начале терапии Дексаметазон применяют в более высоких дозах. В течение суток можно вводить от 4 до 20 мг Дексаметазона в/к либо рядом с формирующимся рубцом [7].
В описании клинического исследования, проводимого в США, изложена одна из методик применения Дексаметазона фосфата. Под общей или спинальной анестезией, проводимой рутинно во время кесарева сечения, выполняется тотальное хирургическое иссечение келоида вне очага поражения и минимальное подмывание препаратом с последующими обычными этапами кесарева сечения. Первичное закрытие раны послойно достигнуто во всех случаях. На кожу накладывают непрерывный подкожный пропиленовый шов 2/0.
Группа А (73 пациентки) не получает дальнейшей терапии, а группе Б (73 пациентки) в края ран однократно вводят Дексаметазон. Используется шприц на 1 мл с иглой 30-го калибра, а инъекция осуществляется как внутрикожно, так и подкожно. Применяют повторные поочередные проколы для промывания краев раны препаратом. Используется приблизительно 0,5–1,0 мл Дексаметазона (4 мг/ мл) в ткани раны однократно. Результаты исследования еще не опубликованы [8].
2.4. Побочные эффекты
Местное введение глюкокортикостероидов может приводить к атрофии кожи, появлению гипо- и гиперпигментации, изъязвлению рубца, синдрому Кушинга. При введении большого количества глюкокортикостероидов в высокой концентрации могут возникнуть системные побочные эффекты (отеки, остеопороз, психические расстройства, язвенная болезнь желудка и двенадцатиперстной кишки и другие осложнения). Инъекции глюкокортикостероидов в периорбитальную область крайне нежелательны, поскольку могут вызвать развитие глаукомы или катаракты.
После 3–4 инъекций почти в 100% случаев развиваются телеангиоэктазии. В случае применения высоких концентраций глюкокортикостероидов (40 мг/мл) и сокращения интервала между инъекциями могут образоваться ксантомы, которые разрешаются самостоятельно в течение года [1].
2.5. Оценка прогноза
Эффективность терапии при лечении келоидов следует оценивать по крайней мере через два года после последней инъекции, чтобы быть уверенным, что рубец не рецидивирует. Тем не менее долгосрочные данные об эффективности лечения келоидов остаются сомнительными. В нескольких независимых исследованиях клиническое улучшение или выздоровление при таком лечении отмечалось в 50–100% случаев, однако частота рецидивов колебалась от 9 до 50% в течение 5 лет после лечения.
Результаты терапии улучшаются, когда КС комбинируют с другими методами лечения, например, с крио- или рентгенотерапией [6]. Новые келоидные образования более чувствительны к терапии, чем старые, сформировавшиеся повреждения [9].
Сочетание с криотерапией
Проведенная за сутки до внутриочаговой инъекции криотерапия жидким азотом помогает проникновению стероида внутрь келоида. При этом под сеансом криотерапии в данном случае следует понимать применение ватного аппликатора, смоченного в жидком азоте, до внутриочагового введения в рубец КС. Также для этой цели возможно применение аппаратов, использующихся для криодеструкции, но с экспозицией аппликатора не более 5 сек., что приведет лишь к интерстициальному отеку поверхностных тканей рубца, как при криотерапии. Проведение же классической криодеструкции за сутки до внутриочаговой инъекции КС приведет к подкожной атрофии [6].
Сочетание с 5-фторурацилом
В некоторых ситуациях для инъекционной терапии больших и плотных келоидов используют комбинацию кортикостероида с 5‑фторурацилом в соотношении 1 : 9, 1 : 3, 1 : 1. Эту смесь вводят в келоид инсулиновым миллилитровым шприцем, оснащенным несъемной иглой диаметром 25–30G. Поскольку инъекции болезненные и требуется с силой давить на поршень шприца, рубец предварительно обезболивают местным анестетиком. Инъекции повторяют с 2‑недельными интервалами до получения хорошего результата. На ночь келоид желательно закрывать силиконовым пластырем или гелем.
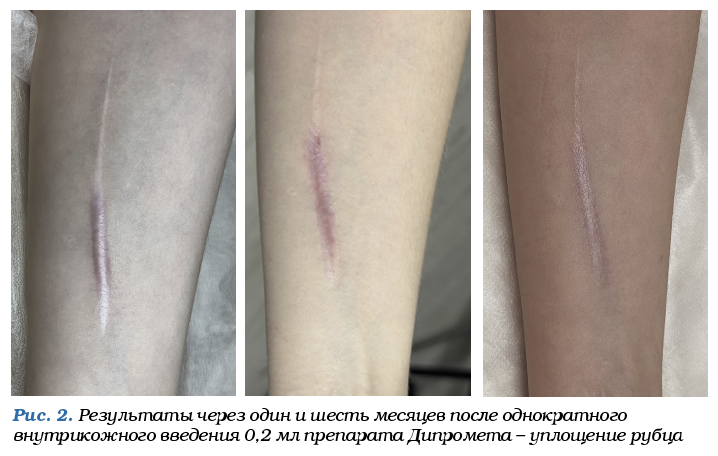
Как только будет заметна регрессия рубца (рис. 2), введение триамцинолона прекращают, а инъекции 5‑фторурацила продолжают. Всего на курс может понадобиться 10–20 процедур, причем чем раньше начато лечение, тем лучше. У пациента на месте келоида остается плоский белый рубец [5].
Многократные подкожные инъекции в область очага и даже в нормальную кожу рядом с очагом также вызывают атрофию и ухудшают внешний вид келоида. Инъекции внутрь очагов сами по себе не изменяют длину и ширину КР [6].
Подбор дозировки Бетаметазона (Дипрометы, Дипроспана)
Препарат Дипромета/Дипроспан выпускается в шприцах/ампулах объемом 1 мл в дозировке 7 мг/мл. При местном введении одновременное применение местноанестезирующего препарата необходимо лишь в редких случаях, т.к. введение препарата безболезненно. Если оно желательно, то препарат Дипромета/Дипроспан можно смешать с одно- или двухпроцентным раствором прокаина или лидокаина, не содержащим метилпарабена, пропилпарабена, фенола и других подобных веществ. В шприц с препаратом Дипромета набирают из ампулы местный анестетик и встряхивают в течение короткого периода времени, после чего полученный раствор вводят в ткань рубца.
Необходимую дозу суспензии препарата Дипроспан сначала из флакона набирают в шприц, затем в этот же шприц набирают из ампулы требуемое количество местного анестетика и встряхивают в течение короткого периода времени. Препарат Дипромета/Дипроспан следует вводить в/к непосредственно в очаг поражения. Если не вводить препарат непосредственно в пораженную ткань, то в ответ на терапию возможно развитие легкого системного эффекта препарата. Препарат Дипромета/Дипроспан вводится в/к (не п/к) в расчете 0,2 мл/см2 (дозировка рассчитывается для неразведенного препарата). Общее количество препарата, вводимого на всех участках в течение каждой недели, не должно превышать 1 мл. Для введения в очаг поражения рекомендуется применять туберкулиновый шприц с иглой калибра 26–27G [7].
Препараты Метилпреднизолон и Дексаметазон пока не включены в клинические рекомендации по лечению ГР (это только в проекте), но тем не менее в их инструкциях есть показания по лечению келоидных рубцов.
Подбор дозировки метилпреднизолона (Депо-Медрол)
Способ введения и режим дозирования подбираются индивидуально в зависимости от характера и тяжести заболевания, возраста и состояния пациента, ответа на проводимое лечение. Техника введения препарата не отличается от вышеописанных. В виде суспензии (депо-форм) препарат вводится в/к в область кожных повреждений не более 20–60 мг с интервалом в 1–4 недели [7].
Подбор дозировки Дексаметазона фосфата
Режим дозирования является индивидуальным и зависит от показаний, состояния больного и его реакции на терапию. Препарат вводят в/в, медленно, струйно или капельно (при острых и неотложных состояниях); в/м; возможно также локальное (в патологическое образование) введение. В остром периоде при различных заболеваниях и в начале терапии Дексаметазон применяют в более высоких дозах. В течение суток можно вводить от 4 до 20 мг Дексаметазона в/к либо рядом с формирующимся рубцом [7].
В описании клинического исследования, проводимого в США, изложена одна из методик применения Дексаметазона фосфата. Под общей или спинальной анестезией, проводимой рутинно во время кесарева сечения, выполняется тотальное хирургическое иссечение келоида вне очага поражения и минимальное подмывание препаратом с последующими обычными этапами кесарева сечения. Первичное закрытие раны послойно достигнуто во всех случаях. На кожу накладывают непрерывный подкожный пропиленовый шов 2/0.
Группа А (73 пациентки) не получает дальнейшей терапии, а группе Б (73 пациентки) в края ран однократно вводят Дексаметазон. Используется шприц на 1 мл с иглой 30-го калибра, а инъекция осуществляется как внутрикожно, так и подкожно. Применяют повторные поочередные проколы для промывания краев раны препаратом. Используется приблизительно 0,5–1,0 мл Дексаметазона (4 мг/ мл) в ткани раны однократно. Результаты исследования еще не опубликованы [8].
2.4. Побочные эффекты
Местное введение глюкокортикостероидов может приводить к атрофии кожи, появлению гипо- и гиперпигментации, изъязвлению рубца, синдрому Кушинга. При введении большого количества глюкокортикостероидов в высокой концентрации могут возникнуть системные побочные эффекты (отеки, остеопороз, психические расстройства, язвенная болезнь желудка и двенадцатиперстной кишки и другие осложнения). Инъекции глюкокортикостероидов в периорбитальную область крайне нежелательны, поскольку могут вызвать развитие глаукомы или катаракты.
После 3–4 инъекций почти в 100% случаев развиваются телеангиоэктазии. В случае применения высоких концентраций глюкокортикостероидов (40 мг/мл) и сокращения интервала между инъекциями могут образоваться ксантомы, которые разрешаются самостоятельно в течение года [1].
2.5. Оценка прогноза
Эффективность терапии при лечении келоидов следует оценивать по крайней мере через два года после последней инъекции, чтобы быть уверенным, что рубец не рецидивирует. Тем не менее долгосрочные данные об эффективности лечения келоидов остаются сомнительными. В нескольких независимых исследованиях клиническое улучшение или выздоровление при таком лечении отмечалось в 50–100% случаев, однако частота рецидивов колебалась от 9 до 50% в течение 5 лет после лечения.
Результаты терапии улучшаются, когда КС комбинируют с другими методами лечения, например, с крио- или рентгенотерапией [6]. Новые келоидные образования более чувствительны к терапии, чем старые, сформировавшиеся повреждения [9].
Сочетание с криотерапией
Проведенная за сутки до внутриочаговой инъекции криотерапия жидким азотом помогает проникновению стероида внутрь келоида. При этом под сеансом криотерапии в данном случае следует понимать применение ватного аппликатора, смоченного в жидком азоте, до внутриочагового введения в рубец КС. Также для этой цели возможно применение аппаратов, использующихся для криодеструкции, но с экспозицией аппликатора не более 5 сек., что приведет лишь к интерстициальному отеку поверхностных тканей рубца, как при криотерапии. Проведение же классической криодеструкции за сутки до внутриочаговой инъекции КС приведет к подкожной атрофии [6].
Сочетание с 5-фторурацилом
В некоторых ситуациях для инъекционной терапии больших и плотных келоидов используют комбинацию кортикостероида с 5‑фторурацилом в соотношении 1 : 9, 1 : 3, 1 : 1. Эту смесь вводят в келоид инсулиновым миллилитровым шприцем, оснащенным несъемной иглой диаметром 25–30G. Поскольку инъекции болезненные и требуется с силой давить на поршень шприца, рубец предварительно обезболивают местным анестетиком. Инъекции повторяют с 2‑недельными интервалами до получения хорошего результата. На ночь келоид желательно закрывать силиконовым пластырем или гелем.
Как только будет заметна регрессия рубца (рис. 2), введение триамцинолона прекращают, а инъекции 5‑фторурацила продолжают. Всего на курс может понадобиться 10–20 процедур, причем чем раньше начато лечение, тем лучше. У пациента на месте келоида остается плоский белый рубец [5].
2.6. Авторские способы лечения келоидных рубцов
Лечение келоидных рубцов, имеющее патент. Целью изобретения является радикальное лечение келоидных рубцов, имеющих значительный срок давности, большую толщину и площадь распространения. Поставленная цель достигается тем, что больным в толщу келоидного рубца вводят суспензию кеналога в количестве 40 мг на 5 см2, но не более 80 мг на весь рубец, равномерно инфильтрируют препаратом ткань рубца и окружающие ткани. Через 30–40 дней пациенту после обезболивания и предварительной ишемизации тканей 0,25-процентным раствором лидокаина и адреналина 1 : 1000 с учетом расположения линий расслабления и естественной складчатости кожи производят хирургическое удаление келоидного рубца в пределах здоровых тканей. После эксцизии производят тщательный гемостаз раны с использованием спрей-коагуляции и последующим наложением внутрикожного шва.
В 1-е, 3-и, 5-е, 7-е и 9-е сутки после операции проводят короткофокусную рентгенотерапию. Разовая очаговая доза составляет в первые сутки после операции 5 г, в последующие – по 3 г. Суммарную очаговую дозу доводят до 17 г.
По предлагаемому авторами «Способу лечения келоидных рубцов» было проведено лечение у 46 больных, с давностью существования келоидных рубцов от 1 года до 10 лет и общей площадью рубцов 159 см2. После проведенного лечения все больные наблюдаются свыше двух лет. За это время у них не обнаружено признаков рецидивирования, сохранился хороший косметический эффект [10].
Еще одна из запатентованных методик лечения ГР и КР – использование инъекций Дипроспана из расчета 7 мг на 5 см2, но не более 14 мг на весь рубец, и с последующим применением инфракрасного лазера с длиной волны 540 нм, длительностью импульсов 1–2 нс (режим генерации Q-sw), с энергией 50–150 мДж и частотой следования импульса 1–4 Гц. Данный способ позволяет получить стойкий клинический результат уже через 8 недель от начала лечения, заключающийся в уменьшении площади рубца (на 22,3%), формировании нормотрофической рубцовой ткани, улучшении консистенции и изменении цвета, характерного окружающей коже. За счет сверхкороткого отрезка времени лазерного воздействия (1–2 нс) и благодаря технологии Q-sw способ является безболезненным и безопасным и не оказывает влияния на окружающие ткани, что подтверждается устойчивым клиническим результатом, наблюдаемым у пациентов через год после лечения [11].
2.7. Аппаратные методики введения ГКС в зону рубцов
Для лечения гипертрофических и келоидных рубцов электрофорезом можно вводить Преднизолон или Дексаметазон 10–15 сеансов ежедневно или через день. Такое же лечение можно осуществлять с помощью лазерофореза и микротоков.
Ультразвук, по данным некоторых авторов, как самостоятельная процедура оказывает на келоидные рубцы положительный эффект, вызывая их размягчение. Использование вместо индифферентного токопроводного геля Лиотон-1000 позволяет создать дополнительный дегидратационный эффект от фонофореза. Введение кортикостероидных препаратов в мазевых формах усиливает результат лечения. Например, однопроцентная гидрокортизоновая мазь назначается ежедневно или через день; курс – 10–15 сеансов. Фонофорезом также вводится гель контрактубекс, эффект от которого благодаря ультразвуку усиливается. Лечение контрактубексом чередуется с кортикостероидными препаратами курсом 10–15 процедур. Курсов может быть 3 или 4 – в зависимости от эффекта [12].
2.8. Классификация ГКС для наружного применения
Несмотря на активность действия топических ГКС, их применение в лечении ГР и КР не отражено в инструкциях по применению данных препаратов (табл. 1) [13].
Лечение келоидных рубцов, имеющее патент. Целью изобретения является радикальное лечение келоидных рубцов, имеющих значительный срок давности, большую толщину и площадь распространения. Поставленная цель достигается тем, что больным в толщу келоидного рубца вводят суспензию кеналога в количестве 40 мг на 5 см2, но не более 80 мг на весь рубец, равномерно инфильтрируют препаратом ткань рубца и окружающие ткани. Через 30–40 дней пациенту после обезболивания и предварительной ишемизации тканей 0,25-процентным раствором лидокаина и адреналина 1 : 1000 с учетом расположения линий расслабления и естественной складчатости кожи производят хирургическое удаление келоидного рубца в пределах здоровых тканей. После эксцизии производят тщательный гемостаз раны с использованием спрей-коагуляции и последующим наложением внутрикожного шва.
В 1-е, 3-и, 5-е, 7-е и 9-е сутки после операции проводят короткофокусную рентгенотерапию. Разовая очаговая доза составляет в первые сутки после операции 5 г, в последующие – по 3 г. Суммарную очаговую дозу доводят до 17 г.
По предлагаемому авторами «Способу лечения келоидных рубцов» было проведено лечение у 46 больных, с давностью существования келоидных рубцов от 1 года до 10 лет и общей площадью рубцов 159 см2. После проведенного лечения все больные наблюдаются свыше двух лет. За это время у них не обнаружено признаков рецидивирования, сохранился хороший косметический эффект [10].
Еще одна из запатентованных методик лечения ГР и КР – использование инъекций Дипроспана из расчета 7 мг на 5 см2, но не более 14 мг на весь рубец, и с последующим применением инфракрасного лазера с длиной волны 540 нм, длительностью импульсов 1–2 нс (режим генерации Q-sw), с энергией 50–150 мДж и частотой следования импульса 1–4 Гц. Данный способ позволяет получить стойкий клинический результат уже через 8 недель от начала лечения, заключающийся в уменьшении площади рубца (на 22,3%), формировании нормотрофической рубцовой ткани, улучшении консистенции и изменении цвета, характерного окружающей коже. За счет сверхкороткого отрезка времени лазерного воздействия (1–2 нс) и благодаря технологии Q-sw способ является безболезненным и безопасным и не оказывает влияния на окружающие ткани, что подтверждается устойчивым клиническим результатом, наблюдаемым у пациентов через год после лечения [11].
2.7. Аппаратные методики введения ГКС в зону рубцов
Для лечения гипертрофических и келоидных рубцов электрофорезом можно вводить Преднизолон или Дексаметазон 10–15 сеансов ежедневно или через день. Такое же лечение можно осуществлять с помощью лазерофореза и микротоков.
Ультразвук, по данным некоторых авторов, как самостоятельная процедура оказывает на келоидные рубцы положительный эффект, вызывая их размягчение. Использование вместо индифферентного токопроводного геля Лиотон-1000 позволяет создать дополнительный дегидратационный эффект от фонофореза. Введение кортикостероидных препаратов в мазевых формах усиливает результат лечения. Например, однопроцентная гидрокортизоновая мазь назначается ежедневно или через день; курс – 10–15 сеансов. Фонофорезом также вводится гель контрактубекс, эффект от которого благодаря ультразвуку усиливается. Лечение контрактубексом чередуется с кортикостероидными препаратами курсом 10–15 процедур. Курсов может быть 3 или 4 – в зависимости от эффекта [12].
2.8. Классификация ГКС для наружного применения
Несмотря на активность действия топических ГКС, их применение в лечении ГР и КР не отражено в инструкциях по применению данных препаратов (табл. 1) [13].

2.9. Особенности оформления медицинской документации при проведении терапии с применением ГКС
При постановке диагноза используется кодирование по МКБ-10:
– 91.0. Келоидный рубец;
– 91.8. Другие гипертрофические изменения кожи;
– L91. Гипертрофическое изменение кожи неуточненное.
Показания к проведению лечения:
– наличие патологического рубца в течение года.
Цель лечения:
– прекращение увеличение рубца в размерах;
– сглаживание рубца;
– изменение окраски рубца до цвета нормальной кожи [4].
При оформлении медицинской документации используется следующая номенклатура медицинских услуг: A11.01.003. Внутрикожное введение лекарственных препаратов.
Наименование услуг согласно Приказу М3 № 804н отражают в следующих документах:
– перечень услуг (прайс).
– договор.
– медицинская карта (ф 025/у, Ф 112).
– талон пациента (ф 025/у-1).
– направление на консультацию (ф 057-у).
– информированное добровольное согласие.
– справка для налоговых вычетов (NB).
– план обследования и лечения.
3 ЗАКЛЮЧЕНИЕ
Таким образом, применение глюкокортикостероидных препаратов в лечении ГР и КР является достаточно эффективным при условии индивидуального подхода с учетом подбора дозировок, интервалов введения и сочетания с другими методами терапии.
Фото любезно предоставлены врачом-дерматовенерологом, косметологом А.С. Воробьевой.
Литература
При постановке диагноза используется кодирование по МКБ-10:
– 91.0. Келоидный рубец;
– 91.8. Другие гипертрофические изменения кожи;
– L91. Гипертрофическое изменение кожи неуточненное.
Показания к проведению лечения:
– наличие патологического рубца в течение года.
Цель лечения:
– прекращение увеличение рубца в размерах;
– сглаживание рубца;
– изменение окраски рубца до цвета нормальной кожи [4].
При оформлении медицинской документации используется следующая номенклатура медицинских услуг: A11.01.003. Внутрикожное введение лекарственных препаратов.
Наименование услуг согласно Приказу М3 № 804н отражают в следующих документах:
– перечень услуг (прайс).
– договор.
– медицинская карта (ф 025/у, Ф 112).
– талон пациента (ф 025/у-1).
– направление на консультацию (ф 057-у).
– информированное добровольное согласие.
– справка для налоговых вычетов (NB).
– план обследования и лечения.
3 ЗАКЛЮЧЕНИЕ
Таким образом, применение глюкокортикостероидных препаратов в лечении ГР и КР является достаточно эффективным при условии индивидуального подхода с учетом подбора дозировок, интервалов введения и сочетания с другими методами терапии.
Фото любезно предоставлены врачом-дерматовенерологом, косметологом А.С. Воробьевой.
Литература
- Городецкий В.В., Тополянский А.В., Лаптев А.О. Глюкокортикоидная терапия сегодня: эффективность и безопасность. МГМСУ. Москва. 2002.
- Духанин А.С. Что определяет эффективность и безопасность местных препаратов для лечения геморроидальной болезни. Хирургия. 10-2017.
- Таганов А.А., Бизунова М.А., Криницина Ю.М. Анализ методов лечения келоидных рубцов. Клиническая дерматология и венерология. 2017;16(3): 97–102.
- Келоидные и гипертрофические рубцы. Клинические рекомендации. Российское общество дерматовенерологов и косметологов. 2015.
- Богачёв В.Ю., Болдин Б.В., Варич Г.А. Консервативные методы лечения и профилактики рубцов кожи. Амбулаторная хирургия, №2/2021.
- Таганов А.В., Брагина А.В. Келоидные рубцы. Современные аспекты диагностики и лечения. Consilium Medicum. 2021; ФГАОУ ВО «Российский университет дружбы народов», Москва, Россия.
- Энциклопедия лекарств РЛС®.
- CICH GCP. Реестр клинических исследований США. Клиническое испытание NCT03239964. Хирургическое иссечение и внутриочаговая инъекция стероидов для предотвращения рецидива келоидного рубца после кесарева сечения. 1.11.2018.
- Чуа С.Ч., Гидашевски Б., Хаджехеи М. Эффективность хирургического иссечения и подкожной инъекции ацетонида триамцинолона для лечения келоидных рубцов после кесарева сечения. Протокол одиночного слепого рандомизированного контролируемого исследования. Испытания 20, 363 (2019). https://doi.org/10.1186/s13063-019-3465-6.
- Cпособ лечения келоидных рубцов. Патентообладатели: Пржедецкий Ю.В., Позднякова В.В., Розенко Л.Я., Франциянц Е.M. Патент RU2195285. 2002 г. Ростовский научно-исследовательский онкологический институт.
- Способ лечения гипертрофических или келоидных рубцов кожи. Патентообладатели: Карапетян Г.Э., Сычев А.Г., Винник Ю.С. Патент RU2335307С1. 2008 г. ГОУ ВПО «Красноярская государственная медицинская академия федерального агентства по здравоохранению и социальному развитию».
- Коэн М. Лечение келоидных рубцов. Перевод: Портнов А. 15.05.2018. «Я живу! Здорово! :)» – информационный web-портал https://ilive-com-ua.turbopages.org.
- Кузнецова И. Глюкокортикостероиды: эффекты, классификация, побочное действие. Медицинский обозреватель. https://okeydoc.